Плазменная технология, основанная на ионизированных газах, уже зарекомендовала себя в хирургии для стимуляции заживления ран. В настоящее время ведутся активные исследования по применению низкотемпературной атмосферной плазмы (НАП) в дерматологии и косметологии.
Сегодня для получения этих ионизированных газов используется несколько методов и конфигураций устройств: объемный и поверхностный диэлектрический барьерный разряд, плазменные струи атмосферного давления, плазменные иглы и карандаши.
Использование устройств различной конфигурации, наряду с выбором подаваемого газа, приводит к получению плазмы с особыми характеристиками. Обычно для получения плазмы используют атмосферный воздух, чистый азот, гелий, аргон или газовые смеси.
Более того, в зависимости от выбранных технических параметров, например, напряжения, частоты, состава газа-носителя и его расхода, а также при различных значениях температуры и влажности, одно и то же отдельное устройство производит совершенно разную плазму, вызывающую различные эффекты.
Принимая эту неоднородность во внимание, мы расскажем об общих особенностях физико-химического воздействия плазмы на биологические ткани и клетки и перечислим перспективные сферы применения данной технологии в дерматологии и косметологии.
Состав низкотемпературной аргоновой плазмы (НТАП), производимой установкой «Плазморан»
НТАП содержит сверхчастотное излучение (ультрафиолетовый, видимый и инфракрасный спектр излучения), а также потоки свободных электронов, ионов, продуктов взаимодействия плазменного луча с окружающим воздухом и образование ряда химических соединений в результате воздействия на биологические ткани.
Ионизированный аргон практически не контактирует с биоматериалом, возвращаясь в инертное состояние. При этом выделяется энергия в виде излучения, которое поглощают молекулы кислорода и азота, образуя молекулы активных форм кислорода (АФК) и азота (АФА) (например, озон – 03).
Из всех возможных факторов, генерируемых плазмой, в биологических процессах в основном участвуют долгоживущие радикалы кислорода и оксид азота, которые напрямую взаимодействуют с биологическими субстратами. Свободные радикалы молекул и атомов служат передатчиками энергии от электронов плазмы к активным атомам или молекулам. Эти соединения стимулируют клеточную активность, а также обладают антимикробным действием.
Действие низкотемпературной атмосферной плазмы на кожу
Влияние активных форм кислорода и азота (АФКА) на биомолекулы
Жидкие биологические среды, обработанные плазмой, богаты АФКА и проявляют интересную биологическую активность в отношении клеток и тканей.
Среди АФКА, образующихся под действием НАП, для биологии большой интерес представляет нитриты (NO2-), нитраты (NO3-), оксид азота (NO•), гидроксильный радикал (•OH), супероксидный анион (O2•-), синглетный кислород (1O2), пероксид водорода (H2O2) и озон (O3).
Биомолекулы, контактирующие с АФКА, могут претерпевать химические изменения, инактивацию или необратимое повреждение. Исследования по анализу химической структуры растворенных в воде аминокислот после воздействия НАП показали, что большинство обработанных аминокислот способны к окислению и приобретают новые химические группы путем гидроксилирования или нитрования.
Показано, что аминокислота цистеин, участвующая в регулировании окислительно-восстановительной активности ферментов и в изобилии содержащаяся в кератине, окисляется под действием НАП.
Поскольку аминокислота при обработке холодной плазмой может быть модифицирована, воздействие НАП может вызвать изменения первичной аминокислотной последовательности либо вторичной и третичной структуры белков в целом. Такие модификации могут изменять активность или вызывать потерю функции белка.
Также было показано, что под действием НАП происходит окисление липидов. Фосфолипиды в составе клеточных мембран могут непосредственно подвергаться перекисному окислению при обработке низкотемпературной плазмой. Это окисление может временно изменить проницаемость клеточной мембраны, облегчая проникновение экзогенных молекул. Окисление липидов – явление, которое в естественных условиях наблюдается при окислительном стрессе и хроническом воспалении.
Модификации и повреждения, вызванные НАП, в равной степени отмечались и в нуклеиновых кислотах, хотя сильные повреждения ДНК наблюдались после длительного воздействия плазмы. Совокупность эффектов НАП в отношении биологических молекул лежит в основе токсического воздействия, которое плазма может оказывать на живую материю.
Хотя холодная плазма является источником потенциально токсичных активных веществ, обработка НАП может вызвать эффект гормезиса, поскольку при правильном применении источники ионизированного газа в адаптированных и контролируемых условиях оказывают благоприятное влияние на обработанную биологическую ткань.
Влияние на клеточный метаболизм
Как уже упоминалось, надлежащая обработка НАП способна, например, ускорять заживление ран или избирательно поражать клетки опухоли, практически не оказывая воздействия на нормальные клетки.
НАП главным образом применяют для лечения легкодоступных тканей и органов, и поэтому она подходит для лечения кожи. Контактируя с внешней средой, кожа постоянно подвергается воздействию физических и химических факторов. Каждый день эпидермис подвергается воздействию ультрафиолетового излучения, озона, табачного дыма, загрязнителей, органических растворителей или спиртов, которые непосредственно вызывают или стимулируют образование большого количества АФК.
Свободные радикалы происходят не только из экзогенных источников, но в меньшей степени имеют эндогенное происхождение, образуясь как продукты клеточного обмена. Ткани человека и животных продуцируют активные формы кислорода, такие как O2•, 1O2, H2O2 и O3. Эти АФК в основном вырабатываются в митохондриях в процессе клеточного дыхания. Хотя эти высокоактивные соединения могут причинять вред, клетки способны нейтрализовать избыток свободных радикалов, используя систему антиоксидантов. Более того, наш организм может адаптироваться к хроническому воздействию токсичных соединений.
Влияние на сигнализацию клеток кожи
АФК играют не только роль повреждающего фактора при высоком содержании, хорошо известного как окислительный стресс, они также являются молекулами, необходимыми для поддержания жизнеспособности и активности клеток. Действительно, в необходимых количествах АФК оказывают некоторые физиологические эффекты, действуя при этом как вторичные мессенджеры, стимуляторы размножения стволовых клеток и иммуностимуляторы.
В поврежденной коже клетки иммунной системы, контактирующие с патогенами, начинают вырабатывать большое количество АФКА. Это явление, называемое «респираторным взрывом», способствует дезинфекции ран. Правильное заживление ран зависит от равновесия между образованием АФК и активностью системы антиоксидантов.
Среди активных форм азота (АФА) небольшая газообразная молекула NO• обладает несколькими биологическими свойствами, действуя как сигнальная молекула, сосудорасширяющее средство, модулятор ангиогенеза, иммуностимулятор и стимулятор меланогенеза.
В коже NO• также участвует в росте волос, пролиферации и дифференцировке эпидермальных клеток и заживлении ран. Нитраты, содержащиеся в поту, могут превращаться в нитриты, а затем в NO• благодаря бактериальной микрофлоре кожи или непосредственно в результате фоторазложения нитритов. Было показано, что полученный в результате фоторазложения нитритов NO• защищает клетки кожи человека от перекисного окисления липидов, а значит, и апоптоза под действием УФ излучения спектра А.
Однако избыточное образование или выраженное воздействие этих активных форм может быть вредным. Действительно, высокие дозы АФК могут способствовать развитию ряда заболеваний, например, псориаза. Более того, окислительный стресс в коже может ускорить естественный процесс старения. Поскольку холодная плазма вызывает образование неоднородной смеси АФКА и многие вышеуказанные активные формы обладают неоднозначными свойствами, конечный эффект в отношении обработанных тканей будет зависеть от количества высвобождаемых активных форм.
Было показано, что обработка НАП вызывает окислительный стресс в кератиноцитах человека, но кратковременное воздействие НАП при подаче гелия с низким расходом повышает жизнеспособность той же клеточной линии. Было отмечено усиление системы антиоксидантов наподобие гормезиса в кератиноцитах человека под действием аргоновой плазмы.
Влияние НАП на пролиферацию клеток и подвижность кожи
Пролиферация клеток кожи важна для регенерации эпидермиса и процесса заживления кожи при повреждениях. При правильном применении лечение НАП может стимулировать эти процессы. Было показано, что непродолжительные воздействия аргоновой плазмы стимулируют пролиферацию и подвижность кератиноцитов человека линии HaCaT.
Обработка НАП ингибирует межклеточные контакты, опосредованные E-кадгерином, и активирует пролиферативный сигнал, опосредованный β-катенином. Этот активируемый плазмой путь пролиферации ускоряет реэпителизацию раны у мышей в условиях in vivo. Кроме того, было показано, что короткие сеансы лечения (1 – 3 мин.) струей аргоновой плазмы повышают пролиферацию кератиноцитов базального слоя в эксплантатах здоровой кожи человека.
На фибробластах кожи показано, что очень короткие сеансы стимулируют пролиферацию, но сеансы длительностью несколько минут оказывают токсическое действие. Более высокая чувствительность фибробластов к обработке НАП, по сравнению с кератиноцитами, может объясняться расположением этих клеток в глубоком слое кожи. Защищенные в глубоких слоях дермы, фибробласты хуже переносят окислительный стресс, вызванный внешними факторами. In vivo фибробласты кожи могут подвергаться непосредственному воздействию НАП только при наличии ран. Более того, при лечении ран антипролиферативный эффект НАП может стать преимуществом, позволяющим предотвратить неэстетичные побочные эффекты процесса заживления, например, избыточное рубцевание.
Влияние НАП на оксигенацию кожи
Было показано, что НАП влияет на содержание кислорода в обработанной мишени. Хотя в плазменных струях скорость потока газа вызывает так называемый «эффект струйной обработки», при котором в обрабатываемой жидкости снижается содержание кислорода, показано, что in vivo при обработке кожи мышей НАП насыщение кислородом нижележащих тканей возрастает.
Увеличение посткапиллярной оксигенации после обработки плазмой наблюдалось и в коже человека. Механизм повышения оксигенации кожи при обработке плазмой in vivo до сих пор неясен. Как упоминалось ранее, генераторы НАП в действительности не являются источниками холодной плазмы, и устройства, применяемые в биологии, позволяют получать плазму с температурой от 30° до 40°C. Обработка кожи плазмой, полученной от этого относительно теплого источника, может вызвать локальное расширение сосудов и тем самым повысить насыщение тканей кислородом.
Кроме того, поскольку НАП прямо или косвенно вызывает образование NO•, эта молекула вазодилататора также может отвечать за наблюдаемое явление. Необходимое насыщение кислородом – основа для правильного клеточного метаболизма. Некоторые косметические методы ухода за кожей основаны на повышении оксигенации тканей.
Гипербарическая кислородная терапия, уже применяемая при кессонной болезни, в настоящее время используется для омоложения кожи. Введение кислорода под давлением, по-видимому, защищает кожу от фотостарения, вызванного УФ излучением спектра B.
Однако оксигенацию кожи следует внимательно контролировать. Кислород оказывает двоякое действие, и его избыток может вызвать окислительный стресс, ускоряющий процесс старения. Кроме того, стволовые клетки кожи нуждаются в крайне низком парциальном давлении кислорода для сохранения своей стволовости и, следовательно, регенерации эпидермиса.
Влияние НАП на васкуляризацию кожи и внеклеточный матрикс
Оксигенация кожи непосредственно связана с васкуляризацией органа. Здоровая кожа имеет хорошо развитую сосудистую сеть. С возрастом активность микроциркуляции кожи, в частности, способность сосудов к расширению и сужению, нарушается, и плотность сосудистой сети снижается.
Неспособность справиться с образующимися АФК и окислительным стрессом эндотелия, по-видимому, является одной из причин потери функциональных возможностей сосудов с возрастом.
Хотя АФК являются понижающими регуляторами функций эндотелия сосудов, лечение НАП в правильных условиях, вероятно, оказывает стимулирующее действие. Показано, что эндотелиальные клетки пупочной вены человека (HUVEC) высвобождают факторы – стимуляторы ангиогенеза и усиливают ангиогенез in vitro при воздействии аргоновой НАП в течение 30 секунд.
Поскольку плазма непосредственно не действует на клетки эндотелия, усиление ангиогенеза in vivo может быть обусловлено паракринным механизмом, опосредованным кератиноцитами, подвергшимися обработке плазмой. Небольшая молекула NO• также играет роль в ангиогенезе. NO•, в зависимости от количества, может действовать как фактор, стимулирующий или ингибирующий ангиогенез.
Более того, NO• может увеличивать синтез коллагена IV и активировать адгезию клеток эндотелия. Исследования показали, что обработка НАП стимулирует выработку эндогенного NO• на моделях in vitro и in vivo. Действительно, на мышиной модели ожоговой раны показано, что АФКА, образующиеся под действием плазмы, повышают экспрессию эндотелиальной синтазы оксида азота (eNOS). Увеличение содержания фермента, продуцирующего эндогенный NO•, наряду с проангиогенными факторами, ускоряет процесс заживления.
При ранах внеклеточный матрикс (ВКМ) дермы непосредственно подвергается обработке НАП, и улучшение показателей заживления может зависеть от непосредственного изменения свойств ВКМ. Обработка плазмой каркасов матрикса коллагена и эластина, имплантированных под кожу мышей, усиливает неоваскуляризацию.
Кроме того, правильно организованный ВКМ также необходим для сохранения молодости кожи. Показано, что в фибробластах мышей, непосредственно обработанных струей аргоновой НАП в течение 15 секунд, повышается экспрессия коллагенов I и III, тогда как более длительные сеансы обработки оказывают противоположный эффект.
В отличие от ран, в здоровой коже НАП не может напрямую влиять на метаболизм внеклеточного матрикса. Однако некоторые исследования in vivo показали, что НАП может опосредованно стимулировать ремоделирование кожи. В дерме здоровой мышиной кожи под действием аргоновой плазмы наблюдалось повышение содержания коллагена.
Коллаген I типа является основным компонентом дермы. Если неосинтез и наличие правильно организованной сети фибриллярного белка являются признаками молодой и здоровой кожи, его избыточная выработка иногда служит проявлением повреждений и заболеваний кожи. Интересно, что НАП способна стимулировать синтез физиологического коллагена, вместе с тем подавляя патологический синтез белка. Исследования in vitro и in vivo показали избирательность данного эффекта при эстетических недостатках кожи, таких как рубцы и келоиды.
Изменение pH под действием НАП
Показано, что АФКА, образующиеся при обработке НАП, обладают не только стимулирующим и окислительным действием, но и вызывают подкисление обработанной мишени. Снижение рН относительного исходного значения обычно наблюдается в небуферных или слабо забуференных обработанных жидкостях и гидратированных 3D-матриксах.
Снижение рН в основном обусловлено кислотными соединениями, получаемыми из предшественника NO•, который в растворе образует азотную (HNO3) и азотистую (HNO2) кислоты.
Вызванное плазмой подкисление пропорционально времени воздействия. Показано, что рН щелочной или нейтральной небуферной среды быстро падает через несколько минут после обработки НАП. Быстрое снижение рН склонно к стабилизации при значениях рН от 3,5 до 2,5 благодаря временному образованию буфера HONO/ONO и азотистой кислоты (pKa 3,3).
В свете сказанного, действие НАП может вызывать снижение рН биологических тканей. Секрет сальных желез свиной кожи и липиды человека могут быстро подкисляться под действием НАП на основе подаваемого воздуха.
Подкисление, вызванное НАП, также было подтверждено клиническими испытаниями на здоровой коже человека. Благодаря подкисляющим свойствам НАП обработка плазмой способствует поддержанию здорового состояния кожи. Действительно, при снижении рН холодная плазма может стимулировать и ускорять обновление кожи.
Показано, что при острой кожной ране физиологическое подкисление повышает активность протеаз и стимулирует пролиферацию фибробластов. Если рН кожи выше физиологических значений может привести к патологии, слишком кислая среда может вызвать ожоги кожного покрова. Во избежание химических ожогов воздействие НАП на кожу необходимо тщательно контролировать.
Однако в косметологии для мягкого удаления наружного слоя эпидермиса и ускорения регенерации кожи используют химический пилинг или эксфолиацию. При таком подходе для снижения рН и удаления слоев эпидермиса часто применяют органические кислоты.
Надлежащая обработка плазмой могла бы возыметь аналогичное неинвазивное отшелушивающее действие. Более того, поскольку рН кислой среды кожного барьера повышается по мере старения, что приводит к ослаблению данного барьера, сеансы обработки НАП могут быть полезными для восстановления барьера с физиологическим значением рН и стимулирования регенерации зрелой кожи.
Влияние НАП на обеззараживание от бактерий и дезинфекцию кожи
Холодная атмосферная плазма обладает хорошо известной бактерицидной активностью. В обработанных НАП растворах, таких как активированная плазмой вода (АПВ), короткоживущие и долгоживущие активные формы, реагируя между собой, образуют мощную антимикробную смесь.
По данным некоторых авторов, биоцидные свойства плазмы в основном определяются сочетанием эффектов окисления и нитрозирования, вызванных синергическим действием H2O2 и NO•.
По отдельности эти две молекулы обладают очень слабой антибактериальной активностью, тогда как при взаимодействии они могут образовывать пероксинитрит (ONOO—), нестабильный изомер NO3-.
Пероксинитрит описан как ключевая активная форма при поражении бактерий, вызванных АПВ. Более того, в АПВ протонированная форма пероксинитрита, пероксиновая кислота (ONOOH), может быть дополнительно окислена H2O2 с образованием пероксинитриновой кислоты (O2NOOH), более сильного бактерицидного вещества.
В составе АФК O3, в основном образующийся под действием НАП, также способствует биоцидному эффекту плазмы. Хотя при непосредственной обработке плазмой за счет химического воздействия короткоживущих и долгоживущих АФКА легко достигается бактерицидный эффект, в реальной жизни большинство микроорганизмов защищены биопленками.
Биопленка – это сложный консорциум различных микроорганизмов, растущих на субстрате. Бактерии встроены в своего рода клейкий внеклеточный матрикс, состоящий из внеклеточных полимерных веществ, таких как полисахариды, липиды, белок и ДНК, значение которых состоит в защите бактерий от обезвоживания и факторов внешней среды.
В НМИЦ колопроктологии им. А.Н. Рыжих было проведено исследование по воздействию низкотемпературной аргоновой плазмы на биопленки микроорганизмов Escherichia coli 317, Klebsiella pneumoniae 458, Pseudomonas aeruginosa 1000, Enterococcus faecalis 458, изолированных из биоматериала пациентов после оперативного вмешательства. Применение НТАП позволило как разрушить биопленочную культуру, так и предотвратить ее образование.
Благодаря своей антимикробной активности генераторы НАП можно использовать как альтернативный и эффективный метод дезинфекции здоровой кожи. НАП может подавлять рост анаэробного патогена Cutibacterium (Propionibacterium) acnes, участвующего в воспалительном процессе в жирной коже, известном как обыкновенные угри, и при других более тяжелых патологиях.
Другие исследования продемонстрировали способность НАП ингибировать рост Malassezia restricta и Malassezia globosa, дрожжеподобных грибков, ответственных за развитие перхоти. Онихомикоз, вызванный бактерией Escherichia coli и грибком Trichophyton rubrum, успешно лечился гелиевой НАП.
Плазма и увлажнение кожи
Здоровая кожа для нормального функционирования нуждается в достаточном количестве воды. Увлажнение дермы обеспечивается благодаря содержанию глюкозаминогликанов (ГАГ) с высокой гигроскопичностью, таких как гиалуроновая кислота. В эпидермисе содержание воды колеблется от 70% в живой части до 15 – 30% в наружных слоях.
Роговой слой способен воспринимать влажность окружающей среды и адаптировать свой биохимический метаболизм. Корнеоциты, мертвые клетки, образующие роговой слой, способны удерживать влагу благодаря гигроскопичным молекулам, составляющим натуральный увлажняющий фактор и кератины. Корнеоциты плотно прилегают друг к другу, предотвращая значительную потерю воды.
Кроме того, межклеточные липиды, такие как церамиды, создают гидрофобный барьер, защищающий от обезвоживания. Обработка холодной плазмой может оказывать двоякое воздействие на увлажнение кожи. НАП сначала может нарушить кожный барьер и высушить наружный слой эпидермиса. Незначительное временное обезвоживание наблюдалось in vivo в роговом слое кожи человека после воздействия плазмы.
Высушивание эпидермиса является желаемым эффектом при плазменном омоложении кожи, когда высушенный неудаленный эпидермис защищает термически поврежденные слои в процессе восстановления. Парадоксально, но поскольку обработка НАП может приводить к появлению заряда на обрабатываемой поверхности, вероятно, после плазменной обработки кожа способна удерживать больше молекул воды. Смачиваемость рогового слоя кожи человека стремительно возрастает в первые секунды обработки плазмой. Повышенная гидрофильность была также показана для ногтей пальцев, плазменная обработка которых улучшает адгезию косметического лака для ногтей.
Применение НТАП в дерматологии
К настоящему моменту был проведен ряд исследований, подтверждающих перспективность применения плазмы в лечении следующих заболеваний:
- Дерматит: аллергический контактный дерматит, атопический дерматит, пеленочный дерматит у детей;
- Псориаз;
- Красный плоский лишай;
- Инфекционные заболевания кожи, вызванные стафилококками и стрептококками;
- Грибковая инфекция;
- Дерматофития, вызванная Trichophyton rubrum, Trichophyton interdigitale, Arthroderma benhamiae, Microsporum gypseum, Trichophyton rubrum и Trichophyton mentagrophytes;
- Онихомикоз, вызванный Candida albicans и Trichophyton mentagrophytes;
- Обыкновенные бородавки, околоногтевые и ладонно-подошвенные бородавки;
- Паразитарная инфекция;
- Демодекоз, вызванный клещами Demodex folliculorum;
- Педикулез трех типов: pediculosis capitis, pediculosis corporis и pediculosis pubis;
- Алопеция.
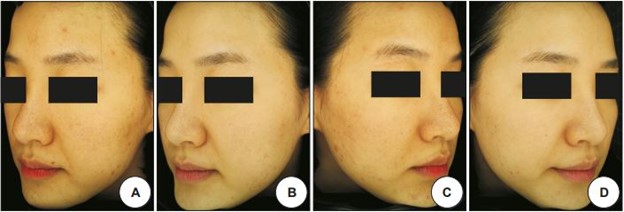
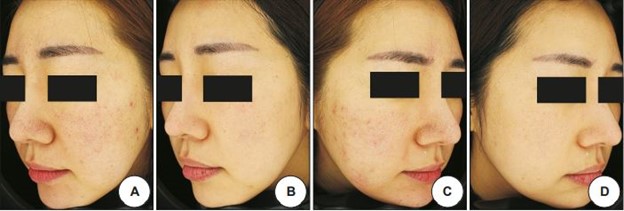
Лечение акне
В университете Квандонг, Корея было проведено исследование по применению аргоновой плазмы для лечения акне. После нескольких сеансов у пациентов отмечалось почти полное улучшение без каких-либо заметных побочных эффектов или рецидивов в течение нескольких месяцев. Полученные результаты позволяют предположить, что аргоновую плазму можно эффективно и безопасно использовать для лечения обыкновенных угрей, особенно воспалительного характера.
Источники:
- Растущие возможности холодной атмосферной плазмы в биологии кожи / Джованни Буско и др. — Журнал Free Radical Biology and Medicine — 161 (2020), 290–304
- Плазменная дерматология: Терапия кожи при помощи холодной плазмы под атмосферным давлением / Тан Ф. и др. – Журнал «Границы в онкологии» — doi: 10.3389/fonc.2022.918484 — 2022
- Низкотемпературная аргоновая плазма регулирует увлажнение кожи. Маркеры регуляции меланогенеза с помощью Yes-ассоциированного белка / Хе Енг Ким и др. – Международный журнал молекулярных наук — 2021
- Аргоновая плазма: новый подход к эффективному лечению обыкновенных воспалительных угрей и расширенных пор у пациентов азиатского происхождения / Сон Чжин Чо и др. — Med Laser 2018; 7(2):97-101
- Применение низкотемпературной аргоновой плазмы в лечении ран после открытой геморроидэктомии / АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук / Туктагулов Н.В./ – Москва. – 2022