Компания «ПлазмоПром» совместно с исследовательскими центрами ГБУЗ ГКБ №67 им. Л.А. Ворохобова и ГБУЗ НИИ СП им. Н.В. Склифосовского провела ряд исследований с целью определить уровень воздействия установки «Плазморан» на патогенную микрофлору, присущую раневым поверхностям человека, а также оценить влияние низкотемпературной аргоновой плазмы на пролиферативную активность фибробластов человека.
НИР Оценка влияния низкотемпературной аргоновой плазмы на выживаемость микроорганизмов in vitro
Объектом исследования являлось действие факторов НТАП на выживаемость патогенных микроорганизмов.
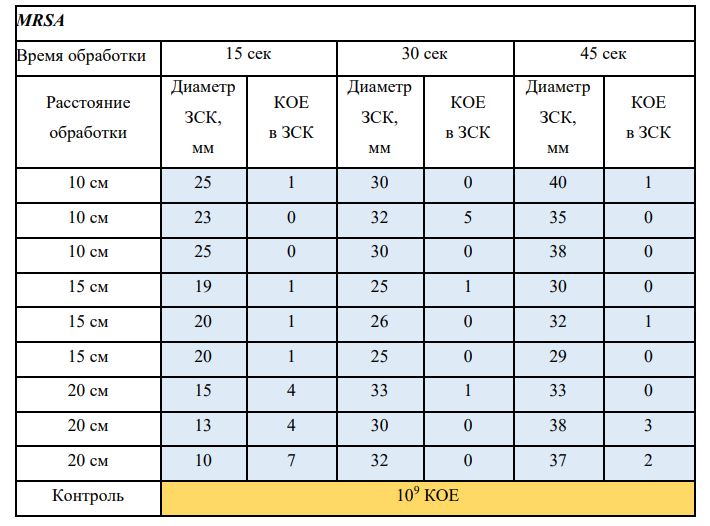
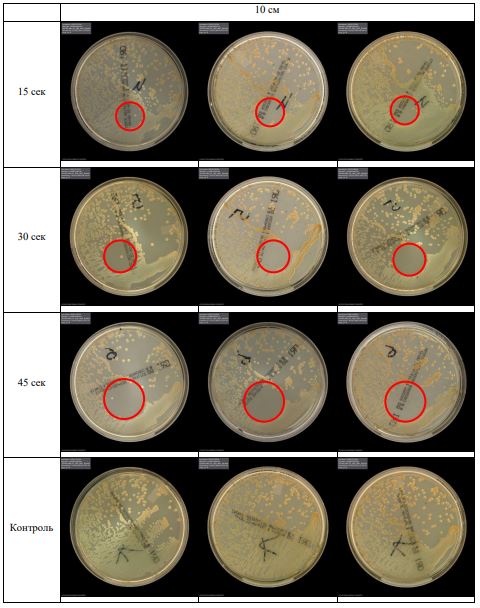
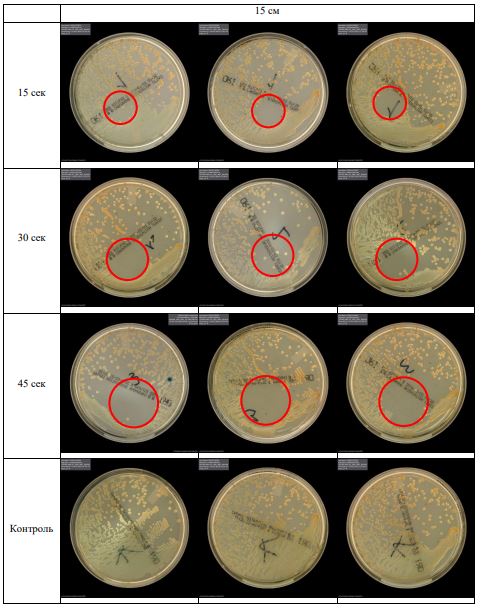
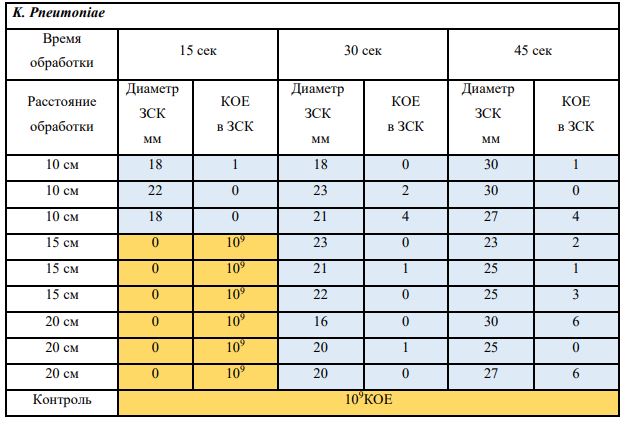
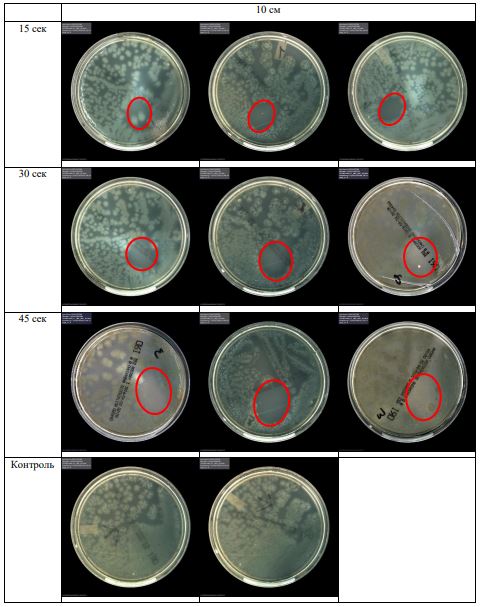
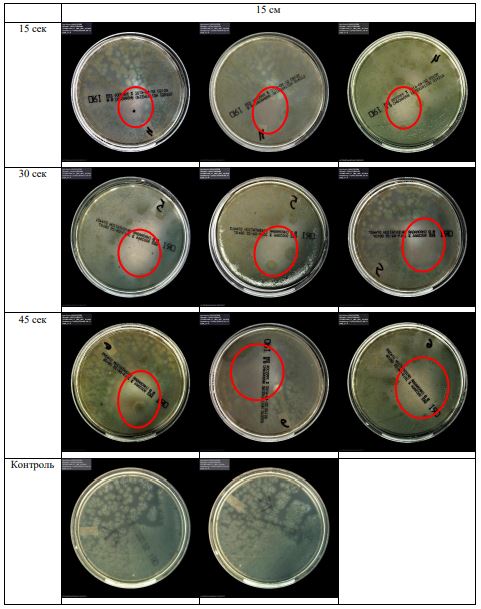
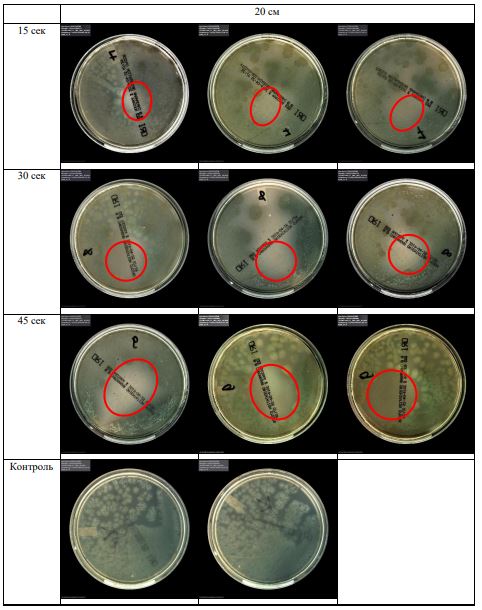
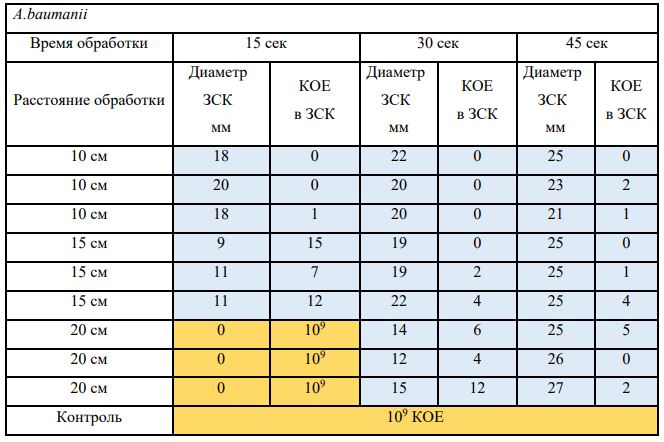
Субъектом исследования являлись патогенные микроорганизмы, полученные с раневой поверхности человека, культивированные на чашках Петри: четыре культуры бактерий –K.pneumoniae, MRSA, A.baumanii, P.aeruginosa, а также одна культура грибов C.albicans.
В процессе исследования вышеупомянутые микроорганизмы были подвергнуты воздействию факторов низкотемпературной аргоновой плазмы: газодинамический поток рабочего газа, рекомбинационное излучение, рабочий газ аргон, озон.
Оценка влияния НТАП на выживаемость патогенных микроорганизмов проводилась через сутки для бактерий и через двое суток для грибов в сравнении с контролем (без действия НТАП).
Проводимое исследование было разделено на несколько этапов:
- Предварительное исследование, в ходе которого была проведена оценка динамического диапазона действия факторов НТАП на выживаемость микробов, а также отработка процедуры и методики проведения исследований.
- Основное исследование по теме настоящей НИР.
- Дополнительное исследование.
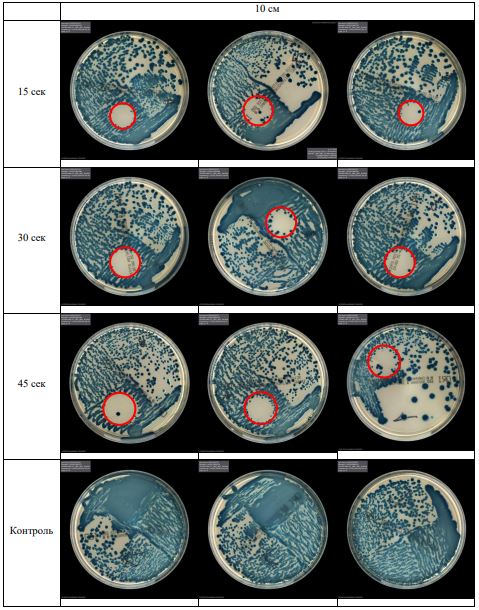
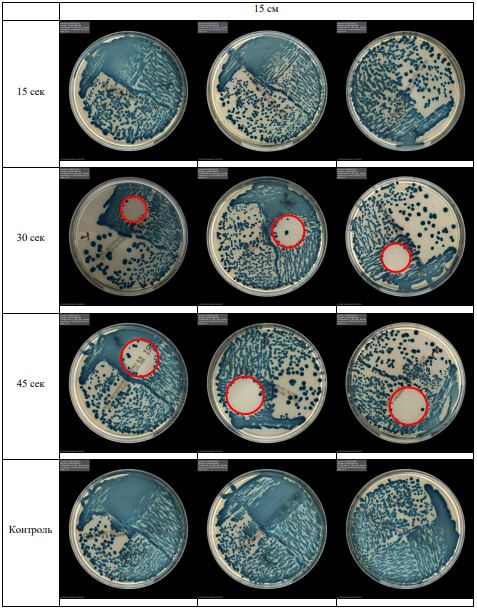
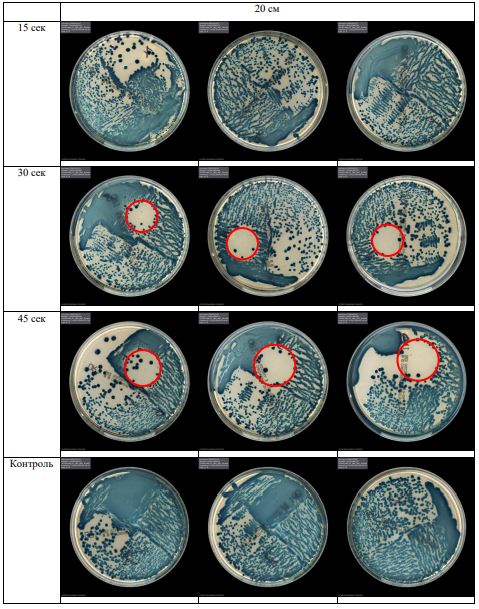
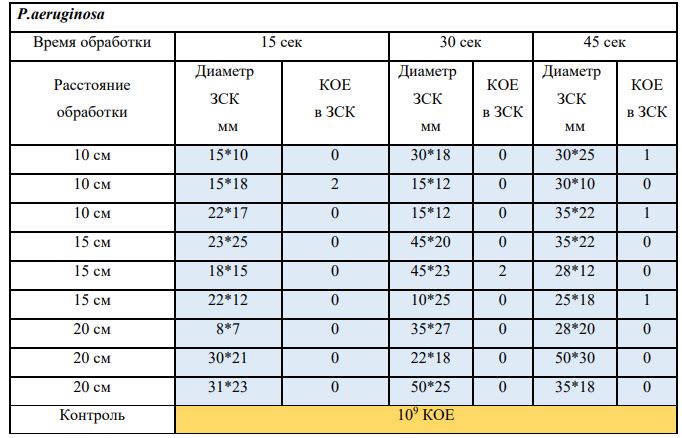
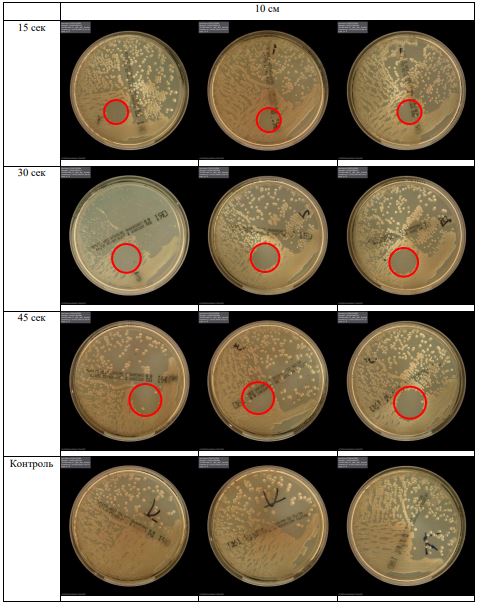
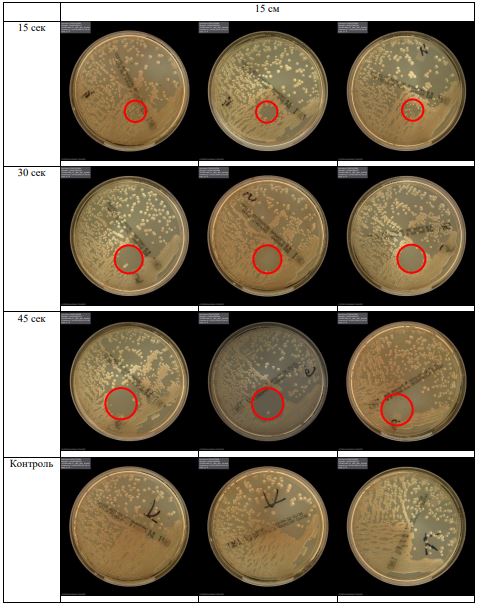
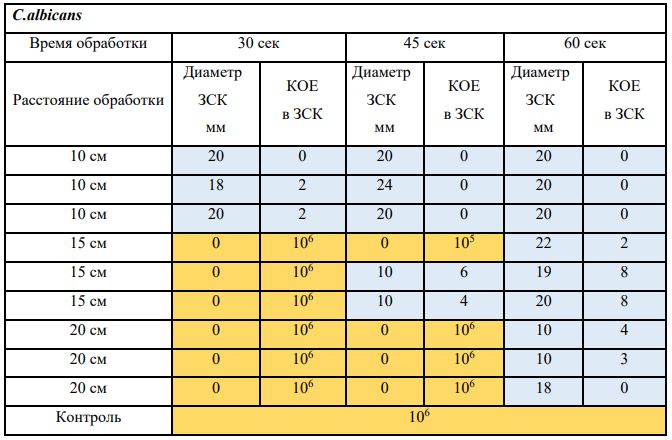
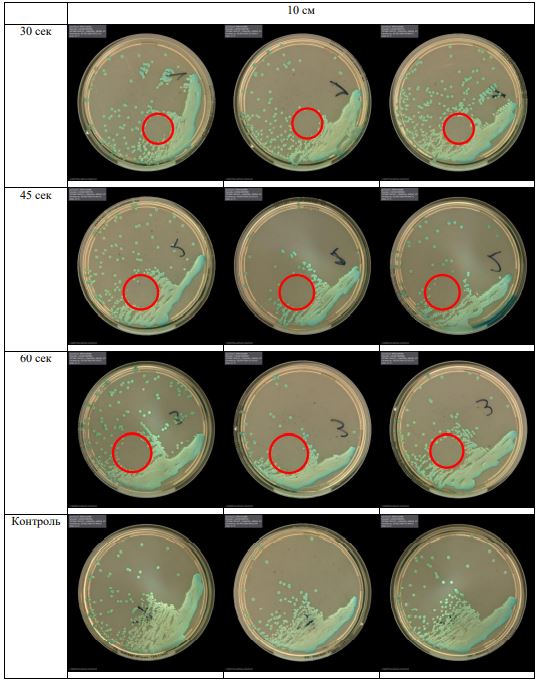
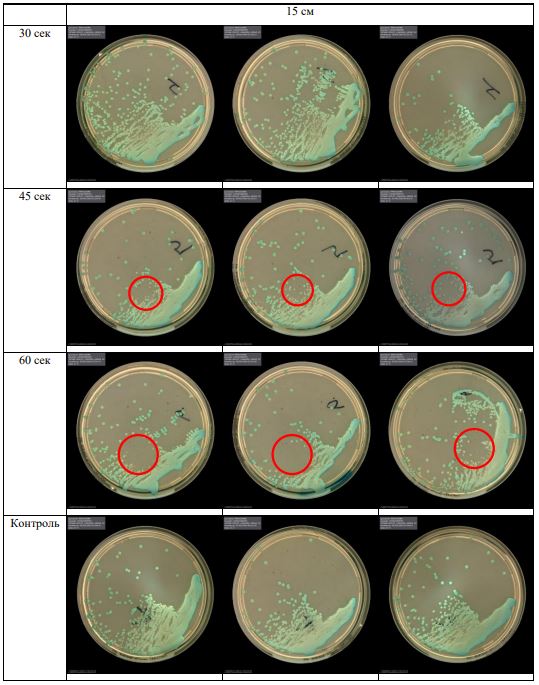
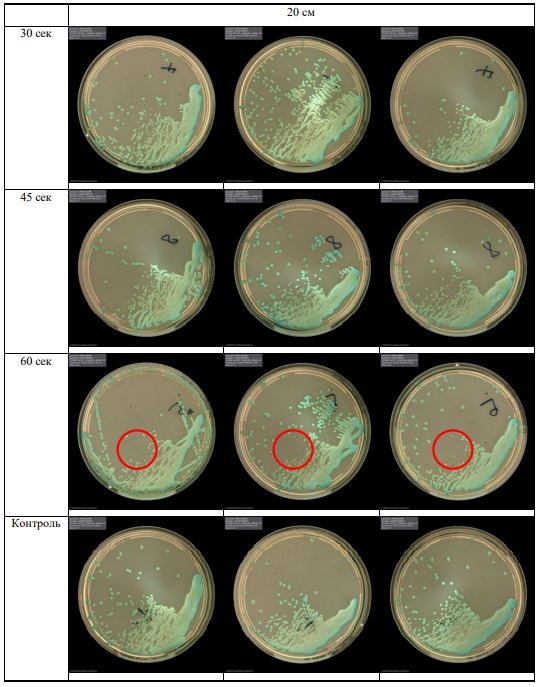
В основной части исследования использовался режим плазмообразования В2. Расстояния от среза сопла плазмотрона до плоскости расположения культуры в чашке Петри (Фактор L): 10 см, 15 см, 20 см. Экспозиция действия факторов НТАП на культуры (Фактор T): для бактерий — 15 сек, 30 сек, 45 сек, для грибов — 30 сек, 45 сек, 60 сек.
Исходная обсемененность посева составляла 10⁸ — 10⁹ КОЕ/мл для всех образцов.
Для каждой основной группы микроорганизмов формировалась контрольная группа, которая не подлежала воздействию факторов НТАП.
Анализ результатов основного исследования
Смотреть Исследование полностью:
PDF-файл с исследованием (Отчет по НИР ГКБ 67 ДЗМ бактериология)
НИР Оценка влияния низкотемпературной аргоновой плазмы на пролиферативную активность фибробластов in vitro
Объектом исследования являлись диплоидные клетки человека – фибробласты линии М-21, подвергшиеся воздействию низкотемпературной аргоновой плазмы.
В работе использовали культуру фибробластов человека (линия М-21, 25 пассаж). В чашки Петри диаметром 3,5 см вносили суспензию, содержащую 30 тыс. клеток в питательной среде ДМЕМ/F12 c добавлением 10% сыворотки эмбрионов коров «Gibco». Клетки помещали в СО2 инкубатор с содержанием углекислого газа в атмосфере 5% и температуре 37° С и культивировали в течение 24 часов для достижения адгезии высеянных клеток. После этого клетки подвергали воздействию низкотемпературной аргоновой плазмы.
Проблематика
Низкотемпературная аргоновая плазма используется при лечении обширных и хронических ран с целью удаления патогенной флоры, удаления клеточного и тканевого дебриса. Есть данные, что воздействие холодной плазмы стимулирует рост и дифференцировку диплоидных клеток человека (Xiong Z, Zhao S, Yan X. Nerve stem cell differentiation by a one-step cold atmospheric plasma treatment in vitro. J Vis Exp. 2019 Jan 11; 143), однако тонкие механизмы такой стимуляции остаются невыясненными. Низкотемпературная плазма заметно повышает проницаемость клеточных мембран, что в ряде случаев может стимулировать проникновение в клетку сигнальных молекул, активирующих ионов (в частности, ионов калия, кальция и магния), и таким образом запускать разные формы клеточной активности.
Данное исследование показало, что при действии аргоновой плазмы отмечается нарушение структурной целостности клеточных мембран, что приводит к снижению адгезивных способностей клетки. Повреждение клеточных мембран также сопровождается гибелью части клеток. Эти эффекты могут быть обусловлены индукцией апоптоза клеток, нарушением экспрессии рецепторов адгезии и другими причинами. Тонкие механизмы такого влияния на фибробласты человека требуют дальнейшего изучения.
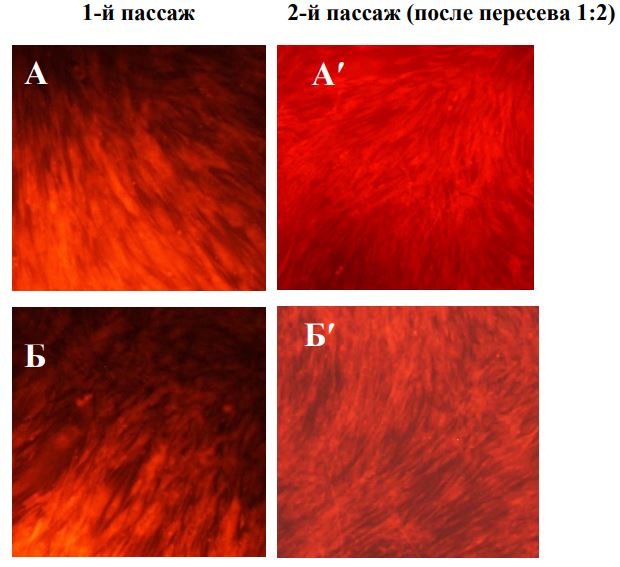
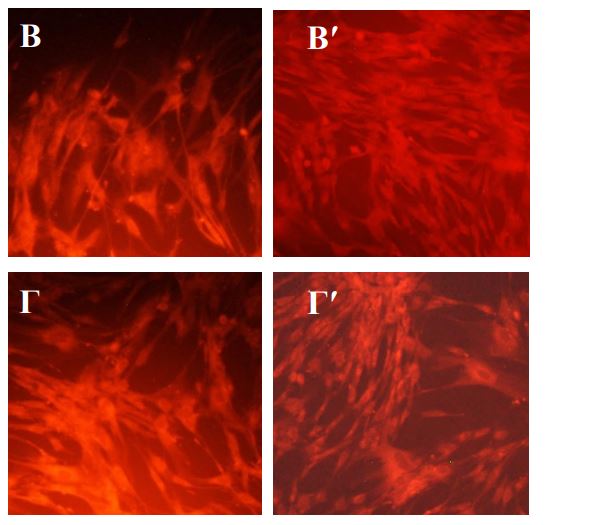
Выраженная активация пролиферации фибробластов наблюдается только во 2-м пассаже, но не непосредственно после воздействия плазмы. В опытах без экранирования значительная часть клеток разрушалась, теряла связь с подложкой в течение 1-3 суток культивирования, в результате через 3 суток в опытах наблюдалась убыль клеток. С другой стороны, такая убыль не препятствовала интенсивному росту клеток во втором пассаже. Не исключено, что под действием плазмы наиболее жизнеспособная часть популяции постепенно кумулирует факторы активации, которые затем способствуют активному делению. Вместе с тем, даже на фоне интенсивного роста во 2-м пассаже многие клетки имеют измененную форму, и не восстанавливают полностью структуру мембран. Наименьшее повреждение клеток отмечено при режиме обработки плазмой 15 сек на расстоянии 25 см. В этом случае нарушения структурная целостность фибробластов была ближе всего к нормальной. В тоже время во втором пассаже пролиферативная активность клеток была как у клеток контрольной серии. Наибольшее стимулирующее действие на пролиферативную активность фибробластов на втором пассаже отмечено при обработке культуры на расстоянии 10 см в течение 30 и 45 секунд и 15 см в течение 45 секунд. При таких режимах обработки клеток аргоновой плазмой на втором пассаже также отмечали восстановление ЦКМ. После воздействия с расстояния 20 см даже на втором пассаже сохранялся низкий показатель структурной полноценности клеток на фоне невысокого пролиферативного потенциала.
Использование экрана в виде коллагеновой повязки позволило значительно повысить сохранность фибробластов в первом пассаже, как с точки зрения общего количества клеток в культуре, так и с точки зрения целостности их мембран. После пересева, клетки, обработанные на расстоянии 10 см с использованием экрана, создавали полноценный конфлюэнтный монослой, плотно заполняя практически все дно чашки Петри.
Витальное окрашивание фибробластов человека после обработки плазмой через 3 суток культивирования. Увеличение х 100. А,А′ – контроль; Б, Б′ – воздействие 10 см -15 сек; В,В′ – воздействие 10 см – 45 сек; Г,Г′ –воздействие 15 см – 45 сек
Стоит отметить, что в отличие от работ in vitro, при клиническом использовании низкотемпературной плазмы воздействие не осуществляется напрямую на монослой клеток. Не исключено, что при клиническом использовании повреждение клеток будет гораздо менее выраженным, чем in vitro. Для лучшего понимания эффекта холодной плазмы необходимо изучить процессы, происходящие в цитоплазме клетки, подверженной воздействию.
Выводы
Смотреть Исследование полностью:
PDF-файл с исследованием (Отчет по НИР НИИСП ДЗМ пролиферация)