Установка «Плазморан» применяется для лечения термических ран, в том числе ожогов. Клиническая эффективность обусловлена интенсивным антибактериальным воздействием, активизацией роста тканей, активизацией выработки эластичного коллагена.
При пластическом закрытии обширных ран с использованием аутодермотрансплантатов, установка благоприятно влияет на раневой процесс, способствуя приживлению трансплантатов и появлению краевой эпителизации за счёт активизации микроциркуляции и процессов репарации.
Вместе с этим, отмечено формирование бледных эластичных физиологичных рубцов. Установка «Плазморан» препятствует образованию грубых келоидных рубцов, что особенно важно для функционально активных анатомических зон.
Основные результаты исследований
Результаты экспериментальных исследований.
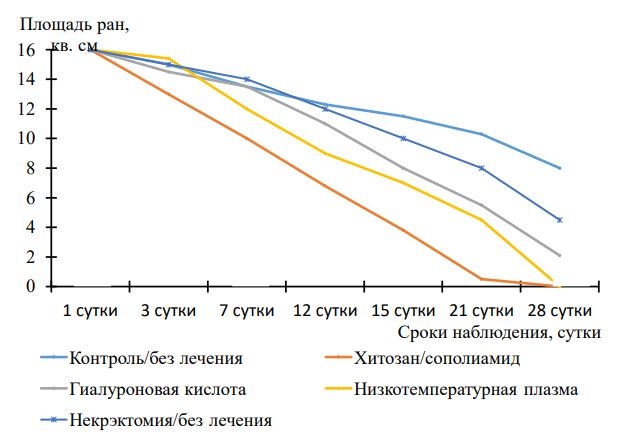
Процессы репарации в области глубокого ожогового поражения после фасциальной хирургической некрэктомии на фоне локального применения низкотемпературной воздушной плазмы коронного разряда имели существенные особенности. В частности, к 12- м суткам наблюдения констатировано сокращение плащади раневого дефекта на 28,75% (p< 0,05), а к 21-м суткам — в 2,5 раз (p< 0,01). Окончательное заживление ран в этой группе животных констатировано на 28-е сутки эксперимента, при этом площадь сформировавшегося рубца была весьма значительной, достигая 3,8 кв.см. Можно заключить об общем ускорении процессов репаративной регенерации на 22% (p< 0,05) по сравнению с контрольной группой.
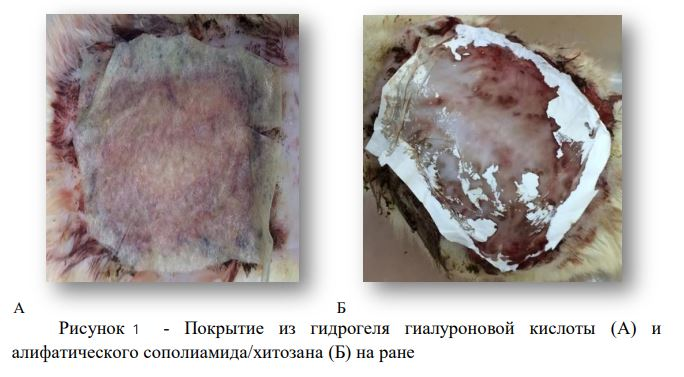
В группе животных, где раневая поверхность после фасциальной некрэтомии была закрыта гистеобиопластическим материалом на основе гидрогеля гиалуроновой кислоты (рис. 2), площадь ран к 12-м суткам наблюдения сократилась на 18,75% (p> 0,05), а к 21-м суткам — на 68% (p< 0,01), к 28-м суткам текущего эксперимента констатировано ускорение процессов регенерации на 14,3 % (р> 0,05) по сравнению с группой контроля на фоне сокращения площади рубца на 71% (р < 0,01). Срок заживления ран у этих животных — 30-е сутки.
Наиболее оптимальные результаты отмечены в группе животных, где для замещения ран после некрэктомии использовали гистеобиопластический материал на основе хитозана и сополиамида (рис. 2). В этой группе площадь ран к 12-м суткам наблюдения сократилась практически в 1,7 раз (p< 0,01), а к 21-м суткам — в 6,4 раза (p< 0,01), за общий период текущего эксперимента констатировано ускорение процессов регенерации на 42,8 % (р < 0,01) на фоне сокращения площади рубца на 65% (р < 0,01) по сравнению с группой контроля. Раны в этой группе животных заживали на 20-е сутки. Сводные данные о сроках заживления ран, динамике площади ран в ходе эксперимента, а также площадь сформировавшихся рубцов к исходу наблюдения в группах животных с учетом избранного метода лечения приводим в таблице 1 и рисунке 2.
Рисунок 2 — Динамика площади ран в ходе эксперимента
| Группы наблюдения | Период заживления, сутки | Площадь рубца, см2 |
|
контроль / без лечения |
35 ± 2,8 |
5 ±0,1 |
|
низкотемпературная плазма |
28 ± 2,0 |
3,8 ± 0,41 |
|
хитозан/сополиамид |
20 ± 3,21 |
2,8 ± 0,71 |
|
гиалуроновая кислота |
30 ± 0,82 |
2,1 ±0,41 |
|
некрэктомия / без лечения |
32 ± 1,62 |
4,5 ± 0,8 |
1 — достоверно (р<0,05) по сравнению с животными контрольной группы/без лечения
2 — достоверно (р<0,05) по сравнению с использованием хитозана/сополиамида
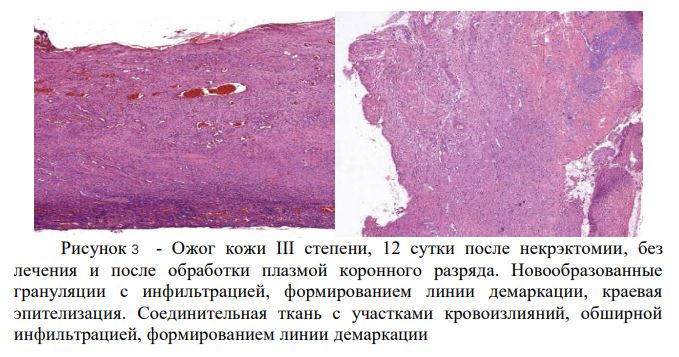
Установлено, что обработка глубоких ожоговых ран после выполнения радикальной некрэктомии низкотемпературной воздушной плазмой коронного разряда сопровождается сокращением площади раневого дефекта спустя 3 недели в 2,5 раза (p 0,05). При морфологическом исследовании биоптатов ран животных контрольной группы в дне раневого дефекта определялись участки соединительной ткани с очагами вторичного некроза и кровоизлияний, воспалительным инфильтратом. Отек выражен, кровоизлияния в глубоких отделах дермы, подкожной клетчатке за пределами раны. Очаги эпителизации в виде клина не выражены (рис. 3).
При исследовании биоптатов животных, раны которых после некрэктомии подвергались воздушно-плазменной обработке, к 12-м суткам эксперимента поверхность в зоне воздействия была покрыта фрагментами тонкой пленки из коагулированных белков, фибрина, лизированных форменных элементов. Эпителизация по краям раны в виде растущего клина, начальные явления дифференцировки (рис. 3).
Важным детерминантом успешного местного лечения ран является антибактериальный компонент ранозаживляющих средств. С этой целью проведена количественная оценка ингибирования роста культуры Staphylococcus aureus 209P in vitro на фоне воздействия плазменного потока положительного коронного разряда, а также других методов. Испытанные ранозаживляющие средства и воздействие плазменного потока оказывали различное антимикробное действие, отраженное по протяженности зоны задержки роста культуры Staphylococcus aureus 209P (табл. 2).
Среди животных контрольной группы, раны у которых после фасциальной некрэктомии в зоне глубокого ожога лечению не подвергались, их самостоятельное заживление завершалось в пределах 35 суток. Общие сроки окончательного заживления ран во второй серии выполненных экспериментов с учетом методик лечения указаны в таблице 3.
| Вид воздействия | Ширина подавления (М ± m) роста культуры (в мм) при размере диска | |
| 6 мм | 12 мм | |
|
контроль, без лечебного воздействия |
0 |
0 |
|
гель карбопола |
0 |
0 |
|
йодопирон |
16,2 ± 1,11,4 |
24,7 ± 1,8 |
|
дермазин |
16,8 ±0,8 1,4 |
23,3 ± 1,61 |
|
гель карбопола с повиарголом |
18,2 ± 1,01,4 |
22,2 ± 1,31 |
|
плазма 5“ |
4,4 ± 0,31,2,3,4 |
6,1 ±0,81,2,3,4 |
|
плазма 15“ |
29,2 ± 2,61,2,3 |
27,4 ± 1,81,2 |
|
плазма 30“ |
31,7 ±4,21,2,3 |
30,5 ± 2,71,2 |
|
дермазин + плазма 15“ |
34,1 ±3,11,2,3 |
39,9 ± 3,61,2,3,4 |
|
гель карбопола с повиарголом + плазма 15“ |
33,6 ± 2,91,2,3 |
37,3 ± 3,81,2,3 |
1 — достоверно (р < 0,05) но сравнению с контролем (без лечебного воздействия)
2 — достоверно (р < 0,05) по сравнению с применением дермазина
3 — достоверно (р < 0,05) по сравнению с применением геля с повиарголом
4 — достоверно (р < 0.05) по сравнению с применением плазмы 15“
| Группы наблюдения | Период заживления, сутки |
|
контроль / без лечения |
35±2,5 |
|
низкотемпературная плазма |
18±1,21,2,3 |
|
раствор антисептика |
28±1,71 |
|
левомеколь |
24±2,11 |
1 — достоверно (р<0,05) по сравнению с контролем
2 — достоверно (р<0,05) по сравнению с использованием раствора антисептиков
3 — достоверно (р<0.05) по сравнению с использованием мази левомеколь
Случаи развития выраженного гнойного воспаления констатированы в 26 (54,1%) наблюдениях. В группах, где для закрытия ожоговых ран после некрэктомии использовались повязки с растворами антисептика или антибактериальной мази, частота развития гнойного воспаления в ранах оказалась чуть ниже и составляла 66,6% и 50%, соответственно. Наименьшая частота местных гнойных осложнений в области послеоперационных ран отмечена в группе животных, раны которых после некрэктомии обрабатывали низкотемпературной плазмой дугового разряда. Показатель в этой группе соответствовал 16,6%. Наибольшая частота развития гнойного воспаления (83,3% — 10 случаев) выявлена среди животных контрольной группы, раны которых лечению не подвергались (табл. 4).
Использование с лечебной целью марлевых повязок с раствором антисептика или антибактериальной мази сопровождалось сокращением площади рубцовой ткани на 25% (p< 0,05), а повязок с мазью левомеколь на 41,7% (p< 0,05) (табл. 5).
| Группы наблюдения | Частота выявления, % |
|
контроль / без лечения |
83,3±6,2 |
|
низкотемпературная плазма |
16,6±1,21,2,3 |
|
раствор антисептика |
66,6±4,71 |
|
левомеколь |
50±3,11,2 |
1 — достоверно (р<0,05) по сравнению с контролем
2 — достоверно (р<0,05) по сравнению с использованием раствора антисептиков
3 — достоверно (р<0.05) по сравнению с использованием мази левомеколь
| Группы наблюдения | Площадь рубца, кв.см. |
|
контроль / без лечения |
12±1,4 |
|
низкотемпературная плазма |
4±0,51,2,3 |
|
раствор антисептика |
9±0,8 |
|
левомеколь |
7±1,11 |
1 — достоверно (р<0,05) по сравнению с контролем
2 — достоверно (р<0,05) по сравнению с использованием раствора антисептиков
3 — достоверно (р<0.05) по сравнению с использованием мази левомеколь
Результаты клинических исследований
Установлено, что при обработке ожоговых поверхностей аппаратом ПЛАЗМОРАН, происходит снижение микробной обсемененности или полная санация ожоговых ран, что, в свою очередь, снижает вероятность развития гнойного воспаленияи ускорения сроков их эпителизации. Результаты сравнительной оценки бактериальной обсемененности до и после обработки ран приведены в таблице 6.
| Возбудитель | Анализируемый показатель в | |||||
| группе I | группе II | группе III | ||||
| до | после | до | после | до | после | |
|
Corynebacterium striatum |
|
|
|
|
4 |
2 |
|
Pseudomonas aeruginosa |
|
|
|
|
4 |
4 |
|
Staphylococcus aureus |
2 |
1 |
3 |
1 |
3 |
2 |
|
Staphylococcus haemolyticus |
3 |
1 |
|
|
1 |
0 |
|
Staphylococcus hominis |
2 |
1 |
|
|
1 |
0 |
|
Klebsiella pneumoniae |
|
|
|
|
1 |
0 |
|
Staphylococcus capitis |
|
|
2 |
1 |
|
|
|
Acinetobacter baumannii |
1 |
0 |
2 |
1 |
|
|
|
Stenotrophomonasmaltophilia |
1 |
0 |
|
|
|
|
|
Staphylococcus cpidermidis |
2 |
2 |
4 |
2 |
1 |
0 |
|
Staphylococcus epidermidis (MRSE) |
2 |
1 |
1 |
1 |
|
|
Результаты сравнительной оценки средних сроков эпителизации ран в анализируемых группах пациентов приведены в таблице 7, данные которой позволяют заключить о том, что аппарат ПЛАЗМОРАН оказывает воздействие на сроки репарации ожогов, при этом после дермабразии сроки эпителизации в среднем ускоряются на 23% (p < 0,05), среди пациентов, перенесших тангенциальную некрэктомию с аутопластикой, сроки эпителизации сокращаются на 13%, при отсроченной кожной пластике анализируемый параметр сокращается на 17% (p < 0,05). У больных с ранней некрэктомией и применением раневых покрытий р=0,0028; в группе с аутопластикой р=0,034, а в группе с пластикой на гранулирующие раны р=0,0047.
|
Сроки эпителизации |
Группа I (M±STD)* |
Группа II (M±STD)* |
Группа III (M±STD)* |
|
После обработки плазмой |
8,7 ± 0,8 суток |
7,4 ± 0,7 суток |
8,9 ± 0,7суток |
|
Без обработки плазмой |
10,6 ± 1,1 суток |
8,5 ± 0,9суток |
10,3 ± 1,2суток |
|
Достоверность (U-критерий Манна- Уитни) |
р =0,0028 |
р =0,034 |
р =0,0047 |
*М — выборочное среднее, STD — выборочное стандартное отклонение.
Заключение
Применение низкотемпературной плазмы атмосферного давления при лечении больных с ожоговой травмой является перспективным методом, позволяющий создать оптимальные условия для регенерации, в том числе и при глубоком поражении. Воздействие плазменного потока позволяет снизить микробную обсемененность раневых поверхностей, снижает частоту гнойных осложнений и улучшает течение раневого процесса.
Выводы исследования
Практические рекомендации
- При диагностике пограничных (дермальных, мозаичных) поражений в первые трое суток после травмы показано выполнение хирургической дермабразии, в ходе которой развитие петехиального кровотечения (т.н. «кровяной росы») свидетельствует о жизнеспособности дермы. Для достижения гемостатического эффекта, снижения микробной нагрузки при сохранении субстратов эпителизации целесообразна прецизионная обработка раневой поверхности потоком низкотемпературной воздушной или аргоновой плазмы атмосферного давления в режиме минимального воздействия, обеспечивающего формирование тонкой биопленки коагулированных белков раневого экссудата (до 10 кв.см. – 30 секунд).
- После выполнения дермабразии пограничных (дермальных) ожоговых поверхностей для ведения ран в послеоперационном периоде целесообразно использовать многокомпонентные раневые покрытия или антибактериальные мази на гидрофильной основе, учитывая фазу воспаления. При обильной экссудации показаны атравматичные сорбционные (гидроколлоидные или губчатые) повязки. При умеренном уровне экссудации возможно использование повязок на гидрогелевой основе, а также на основе природных полимеров (хитина/хитозана или гиалуровной кислоты).
- Замена раневых покрытий осуществляется при выраженной экссудации, воспалительной реакции, нагноении ран. Патогенетически-обусловленным является курсовая обработка раневых дефектов потоком низкотемпературной воздушной или аргоновой плазмы атмосферного давления в режиме минимального воздействия (до 10 кв.см. – 30 секунд) перед повторной апликацией ранозаживляющих средств.
- Система активного хирургического лечения пострадавших от ожогов должна включать превентивную обработку потоком низкотемпературной воздушной или аргоновой плазмы атмосферного давления, в режиме минимального воздействия, обеспечивающего формирование тонкой биопленки коагулированных белков раневого экссудата (до 10 кв.см. – 30 секунд) — всех послеоперационных ран после ранних (до развития гнойного воспаления под некротизированными тканями, струпом), в т.ч. обширных, фасциальных или тангенциальных хирургических некрэктомий (индекс некрэктомии не менее 0,5 ед.) с одномоментной или отсроченной кожной пластикой.
Источники:
- Диссертация: «Патогенетическое обоснование применения низкотемпературной плазмы для лечения ожогов», К.Ф. Османов, ФГБВОУ Военно-медицинская академия имени С.М.Кирова Министерства обороны РФ
- «Совершенствование физических факторов в местном лечении ожоговых ран», С.Б. Богданов, Е.В. Зиновьев, К.Ф. Османов и др. – Инновационная медицина Кубани №1 (13)/2019 — УДК 616-001.17:537.5